PI: Carine Vergne-Vaxelaire
Nous recherchons des Amine déshydrogénases (AmDHs) aux substrats / propriétés / structures variés au sein de la biodiversité pour fournir à la communauté de biocatalyse des alternatives aux autres enzymes NAD(P)-dépendantes répertoriées catalysant aussi l’amination réductrice.1
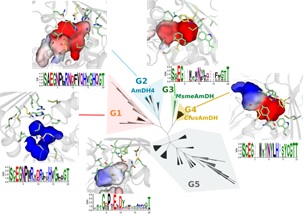
En collaboration avec G. Grogan (York University, UK) et les équipes de l’UMR expertes en bioinformatique (lien LABGEM, LAGE) et production d’enzymes (lien LGBM), nous avons identifié une famille AmDH de plus de 17 000 membres. Leurs applications en synthèses sous forme natives ou modifiées sont prometteuses au vu des validations faites à l’échelle du laboratoire.2-10
Ce travail est soutenu à travers les projets MODAMDH (ANR-19-CE07-0007) et ALADIN (ESR/EquipEx+ ANR-21-ESRE-0021).
- Ducrot L., Bennett M., Grogan G., Vergne-Vaxelaire C. NAD(P)H‐Dependent Enzymes for Reductive Amination: Active Site Description and Carbonyl‐Containing Compound Spectrum ; Adv. Synth. Catal., 2020, 363(2), 328-351; doi: 10.1002/adsc.202000870
- Mayol O., David S., Darii E., Debard A., Mariage A., Pellouin V., Petit JL., Salanoubat M., de Berardinis V., Zaparucha A., Vergne-Vaxelaire C., Asymmetric reductive amination by a wild-type amine dehydrogenase from the thermophilic bacteria Petrotoga mobilis; Catal. Sc. Technol. 2016, 6, 7421-7428; doi: 10.1039/c6cy01625a
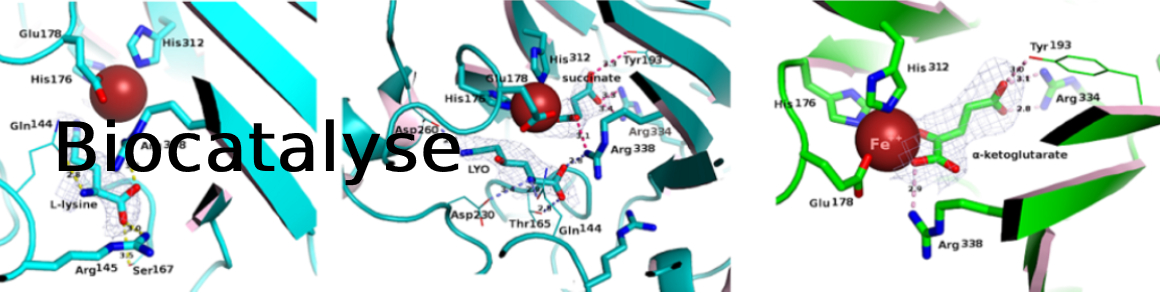
- Mayol O., Bastard K., Beloti L., Frese A., Turkenburg J., Petit JL., Mariage A., Debard A., Pellouin V., Perret A., de Berardinis V., Zaparucha A., Grogan G., Vergne-Vaxelaire C., A family of native amine dehydrogenases for the asymmetric reductive amination of ketones; Nat. Catal., 2019, 2, 324-333; doi: 10.1038/s41929-019-0249-z
- Vergne-Vaxelaire C., de Berardinis V., Zaparucha A., WO2019008110
- Caparco A., A.Pelletier E., Petit JL., Jouenne A., Bommarius B., de Berardinis V., Zaparucha A., Champion J., Bommarius A., Vergne-Vaxelaire C., Metagenomic Mining for Amine Dehydrogenase Discovery; Adv. Synth. Catal., 2020, 362(12), 2427-2436; doi: 10.1002/adsc.202000094
- Bennett M., Ducrot L., Vergne-Vaxelaire C., Grogan G. Structure and Mutation of the Native Amine Dehydrogenase MATOUAmDH2; ChemBioChem, 2022, 23(10), e202200136; doi: 10.1002/cbic.202200136
- Ducrot L., Bennett M., Caparco A., Champion J., Bommarius A., Zaparucha A., Grogan G., Vergne-Vaxelaire C., Biocatalytic Reductive Amination by Native Amine Dehydrogenases to Access Short Chiral Alkyl Amines and Amino Alcohols; Frontiers in Catal., 2021, 1; doi: 10.3389/fctls.2021.781284
- Jongkind E., Fossey-Jouenne A., Mayol O., Zaparucha A., Vergne-Vaxelaire C., Paul E., Synthesis of Chiral Amines via a Bi-Enzymatic Cascade Using an Ene-Reductase and Amine Dehydrogenase; ChemCatChem, 2022, 14, e202101576; doi: 10.1002/cctc.202101576
- Ducrot L., Bennett M., André-Leroux G., Elisée E., Marynberg S., Fossey-Jouenne A., Zaparucha A., Grogan G., Vergne-Vaxelaire C., Expanding the Substrate Scope of Native Amine Dehydrogenases through In Silico Structural Exploration and Targeted Protein Engineering; ChemCatChem, 2022, 14(22), e202200880; doi: 10.1002/cctc.202200880
- Fossey-Jouenne A., Ducrot L., Jongkind E., Elisée E., Zaparucha A., Grogan G., Paul C., Vergne-Vaxelaire C., Native amine dehydrogenases can catalyze the direct reduction of carbonyl compounds to alcohols in the absence of ammonia; Frontiers in Catal., 2023, 3; doi: 10.3389/fctls.2023.1105948.