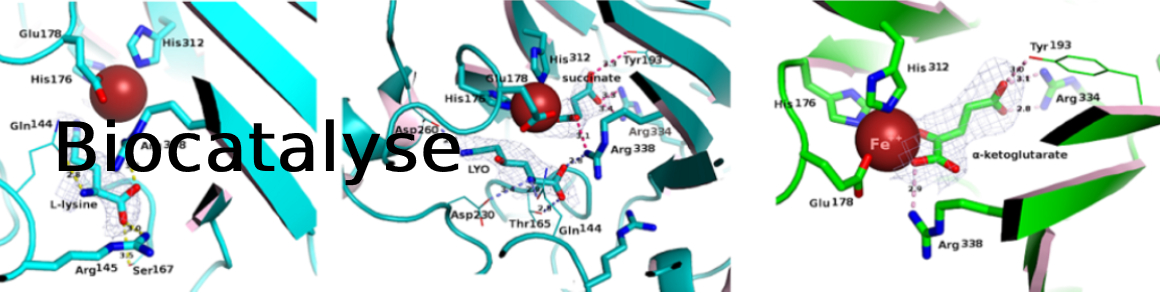
PI: Anne Zaparucha
Les CoA ligases (EC 6.2.1.X) sont des enzymes ATP dépendantes catalysant l’adénylation d’acides carboxyliques puis la conversion de l’acyl-adénylate en thioester de coenzyme A. La réaction native peut être détournée par addition d’un nucléophile externe, comme une amine, sur l’acyl-adénylate pour conduire à la formation de l’amide correspondante.
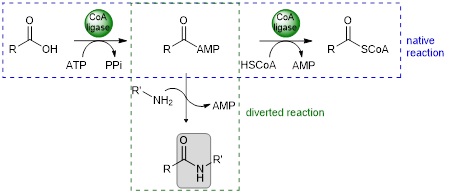
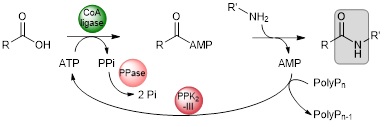
L’addition non catalysée du nucléophile externe est favorisée à température élevée. Pour mettre en place une cascade chemo-enzymatique monotope il faut alors disposer de CoA ligases thermophiles, capables de supporter la température du milieu réactionnel. Nous avons donc constitué une collection de CoA ligases thermophiles. En parallèle nous avons mis au point un système de recyclage de l’ATP par action combinée d’une polyphosphate kinase PPK2-III et d’une pyrophosphatase.1
Après nous être intéressés à la synthèse de lactames nus, sujet pour lequel nous avons noué une collaboration avec D.B. Janssen et A.-M. Thunnissen (university of Groningen, NLD), nous travaillons à la synthèse de lactames fonctionnalisés.
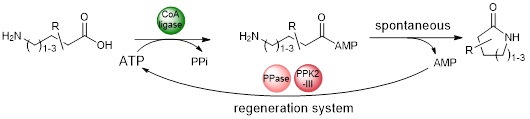
Cette thématique se poursuit au travers l’ANR SMALA dont nous sommes coordinateurs (ANR-21-CE07-0061).
- Lelièvre C. M., Balandras M., Petit J.-L., Vergne-Vaxelaire C., Zaparucha A., ATP regeneration system in chemoenzymatic amide bond formation with thermophilic CoA ligase; ChemCatChem 2020, 12, 1184-1192; DOI:10.1002/cctc.201901870